6月7日诀汁,美國食品和藥品管理局(FDA)宣布加速審批渤饺苣酢(Biogen)/衛(wèi)材(Eisai)公司治療早期阿爾茨海默病(Alzheimer’s disease探悲,AD)患者的新藥Aduhelm(aducanumab沽怪,阿杜卡瑪單抗)上市。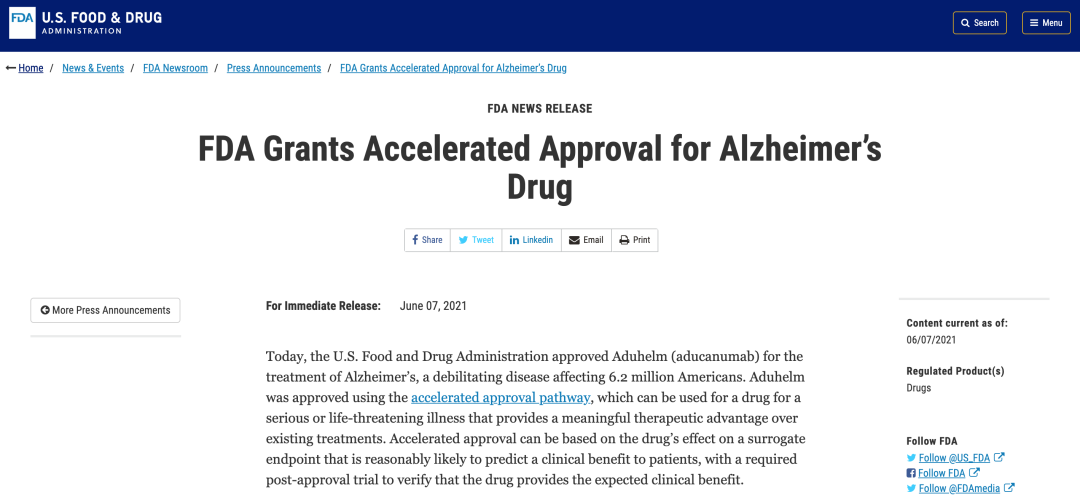
這是美國監(jiān)管機(jī)構(gòu)批準(zhǔn)的首款能減緩阿爾茨海默癥患者認(rèn)知能力下降的藥物姿锭,之前的藥物僅是對癥治療塔鳍,可短期改善癥狀,無法延緩疾病進(jìn)程呻此。Aduhelm也是自2003年以來獲批用于治療阿爾茨海默病的首個新藥轮纫。眾所周知,阿爾茨海默病的新藥研發(fā)焚鲜,是藥物研發(fā)中的“地獄模式”掌唾。新藥Aduhelm的上市,可以說為這一被多數(shù)制藥巨頭放棄的疾病領(lǐng)域帶來了新的希望忿磅。但是糯彬,由于臨床試驗結(jié)果證據(jù)薄弱且相互矛盾,F(xiàn)DA的這一決定遭到了眾多學(xué)者的反對。 AD新藥研發(fā)艱難
AD新藥研發(fā)艱難
阿爾茨海默擦冒恰(簡稱AD)俗稱老年癡呆癥叽粹,是和年齡相關(guān)的進(jìn)行性認(rèn)知障礙疾病。早期以明顯記憶下降為主却舀,逐漸喪失日常生活能力,并伴有精神癥狀和行為障礙新砖,病情呈進(jìn)行性進(jìn)展了灾,晚期常出現(xiàn)吞咽困難,臥床不起冒衍,發(fā)病十年左右胖直,常因感染等并發(fā)癥死亡。世界衛(wèi)生組織(WHO)估計全球65歲以上老年人群阿爾茲海默癥的患病率為4%~7%搭屿,中國65歲及以上的阿爾茨海默病患病率為5.56%腋民。

據(jù)《世界阿爾茨海默病2018年報告》顯示,全球目前至少有5000萬的癡呆患者(包括血管性癡呆探龟、額顳葉癡呆项起、路易體癡呆、帕金森病癡呆否癣、阿爾茨海默病等)廊珊,其中,有約60%-70%為阿爾茨海默病患者栏荷。我國目前約有1000萬阿爾茨海默病患者答倡,居世界首位,而由于我國已經(jīng)進(jìn)入人口老齡化快速發(fā)展階段驴党,因此我國也是全球新發(fā)病例增速最快的國家之一瘪撇。與此相對的是,阿爾茨海默病治療藥物研發(fā)艱難港庄。美國藥品研究與制造商協(xié)會(PhRMA)發(fā)布的報告指出倔既,1998年-2017年間, 全球有146個阿爾茨海默病藥物在臨床研發(fā)中心遭遇失敗攘轩,40%夭折于早期臨床階段叉存,39%在中期臨床宣布失敗,18%在三期臨床失敗度帮。
該報告指出歼捏,此前僅有6種阿爾茨海默病藥物獲FDA批準(zhǔn)上市,分別為1993年批準(zhǔn)的他克林笨篷、1996年批準(zhǔn)的多奈哌齊瞳秽、2000年批準(zhǔn)的卡巴拉汀、2001年批準(zhǔn)的加蘭他敏、2003年批準(zhǔn)的鹽酸美金剛练俐、2014年批準(zhǔn)的美金剛/多奈哌齊復(fù)方制劑(不算新藥)靡玲。而在Aduhelm上市以前,治療阿爾茨海默病的藥物都只能改善患者的癥狀锡锐,不能減輕AD的病理變化铆羡,也不能逆轉(zhuǎn)或減緩疾病進(jìn)程。根據(jù)FDA藥物評估和研究中心主任操椰、醫(yī)學(xué)博士Patrizia Cavazzoni所言能狼,Aduhelm是第一種針對阿爾茨海默病基本病理生理學(xué),并對其產(chǎn)生影響的療法跌仗。FDA批準(zhǔn)的理由是:強(qiáng)有力的證據(jù)表明該藥物能可以清除β-淀粉樣蛋白顺雪,這種蛋白質(zhì)積聚在阿爾茨海默病患者的大腦中,被認(rèn)為會導(dǎo)致神經(jīng)元損傷掩若。FDA表示嘁凤,減少這些斑塊“有理由預(yù)測這對患者有著重要益處”。阿爾茨海默病的發(fā)病機(jī)制目前仍然是謎快鬓,這也是該病藥物研發(fā)進(jìn)展緩慢的主要原因租躁。其中“β-淀粉樣蛋白異常沉積”是解釋阿爾茨海默病最為廣泛的假說,而Aduhelm的研發(fā)正是基于該假說哈误。Aduhelm是一種單克隆抗體哩至,可以有選擇性地與β-淀粉樣蛋白沉積結(jié)合,通過激發(fā)免疫反應(yīng)蜜自,進(jìn)而清除沉積的蛋白斑塊菩貌。但問題在于,淀粉樣蛋白假說本身重荠,也充滿著爭議箭阶。淀粉樣蛋白假說認(rèn)為,阿爾茨海默病是因為一種黏附戈鲁、可溶蛋白——β-淀粉樣肽——在腦細(xì)胞空隙處堆積而導(dǎo)致的仇参。這些肽從包埋在神經(jīng)元膜內(nèi)的另一種蛋白上切割下來,一旦能自由移動婆殿,它們就會聚集成更大的結(jié)構(gòu)诈乒,如果無法被特殊的酶有效地清除,它們就會形成斑塊婆芦。這些斑塊會引發(fā)致命的級聯(lián)反應(yīng):誘發(fā)神經(jīng)炎癥怕磨,產(chǎn)生大量名為tau纏結(jié)的黏性蛋白束,長此以往绣摹,神經(jīng)元便會死亡醇颗。該假說的批評者指出陨楼,許多沒有阿爾茨海默病的人,其死后大腦中也有斑塊搭诬。此外蘸橡,他們還提到,為溶解淀粉樣蛋白斑塊而開展的大量臨床試驗都失敗了转傍,那些療法無一能減慢疾病的進(jìn)展层褥。我國有科學(xué)家也指出,有研究表明糜实,降低大腦內(nèi)的斑塊無法阻止阿爾茨海默疾病發(fā)展怖冷;其次,諸多抗體叼河、γ/β分泌酶抑制劑等臨床研究表明,清除大腦內(nèi)的斑塊反而會增加認(rèn)知損害和功能衰退济七。因此川愤,淀粉樣蛋白是阿爾茨海默病的一個非常重要的特征,但不能簡單地將其作為導(dǎo)致阿爾茨海默病的病理學(xué)因素碍讯。除了淀粉樣蛋白假說本身的爭議悬蔽,Aduhelm的臨床試驗結(jié)果,也是自相矛盾的捉兴。2007年11月蝎困,渤健從Neurimmune獲得Aduhelm的研發(fā)許可。2015年倍啥,有197名輕度患者入組的1b期臨床試驗(103號)顯示禾乘,Aduhelm能夠減緩阿爾茨海默病患者的惡化速度,保護(hù)患者的認(rèn)知能力虽缕。基于此始藕,渤健與其合作伙伴日本制藥公司衛(wèi)材開始了兩項大規(guī)模臨床三期試驗,分別為 ENGAGE(301號)和 EMERGE(302號)氮趋。然而伍派,在2019年3月,渤健突然宣布提前終止這兩項全球III期研究剩胁。理由是诉植,通過對2018年12月26日之前的數(shù)據(jù)進(jìn)行分析后,獨立的數(shù)據(jù)監(jiān)測委員會認(rèn)為Aduhelm對于阿爾茨海默病以及輕度阿爾茨海默病癡呆引起的輕度認(rèn)知功能損傷沒有改善作用楞虾,達(dá)到預(yù)期療效的可能性很小蘑砖。但隨后不久,事情又出現(xiàn)了180°的逆轉(zhuǎn)裕唯。2019年10月23日五浊,渤健和衛(wèi)材公司宣布萄瞻,計劃在第二年向FDA遞交Aduhelm的生物制品申請,治療早期阿爾茨海默病患者菲缕。理由是趁室,在對新的補充數(shù)據(jù)分析后(2018年12月26日之后到2019年3月該試驗被宣布無效之前,318位完成78周試驗的受試者的數(shù)據(jù))聂幅,公司發(fā)現(xiàn)雖然在301號試驗中吓蝌,Aduhelm的效果不明顯,但在302號試驗中能夠改善患者的認(rèn)知能力活乘。在補充數(shù)據(jù)中授工,試驗結(jié)果顯示,在EMERGE(302號)臨床試驗中价恨,接受高劑量Aduhelm治療的患者組细层,衡量認(rèn)知能力的臨床癡呆評分總和量表(CDR-SB)評分降低22%(評分降低意味著疾病癥狀惡化速度減緩),而在ENGAGE(301號)臨床試驗中唬涧,同樣接受高劑量Aduhelm治療的患者組CDR-SB評分反而升高了2%疫赎。基于此,渤健和衛(wèi)材提交了Aduhelm的上市申請后碎节,在由FDA組織的專家委員會中捧搞,幾乎所有的專家都對該藥投出了反對票,他們認(rèn)為陽性試驗的數(shù)據(jù)不是該藥物“有效性的主要證據(jù)”狮荔。專家委員會的大部分人認(rèn)為胎撇,Aduhelm在兩項設(shè)計相同的3期臨床試驗中獲得了截然相反的試驗結(jié)果,而公司無法給出令人信服的解釋殖氏。并且晚树,研究中出現(xiàn)的潛在安全性隱患亦值得關(guān)注。盡管如此雅采,F(xiàn)DA還是違背了其專家顧問的建議题涨,做出了批準(zhǔn)上市的決定。FDA在其 6月7日發(fā)布的公告中指出总滩,阿爾茨海默病是一種影響620萬美國人的毀滅性疾病纲堵,該病會對患者及其家人的生活產(chǎn)生深遠(yuǎn)影響。同時FDA承認(rèn)蝌秕,這些對早期疾病患者的研究“在臨床獲益方面存在不確定性”灌蛙,但FDA仔細(xì)審評了臨床試驗結(jié)果,征求了外周和中樞神經(jīng)系統(tǒng)藥物咨詢委員會的意見镐赖,也聽取了患者群體的觀點(如阿爾茨海默癥協(xié)會和大量患者的呼吁)又诡,最終確定有實質(zhì)性證據(jù)表明Aduhelm可減少大腦中的β-淀粉樣斑塊,且這些斑塊的減少可合理預(yù)測患者的重要獲益从巾。或許FDA正是基于在阿爾茨海默病治療方面巨大的社會壓力和輿論訴求懦诸,才最終選擇為Aduhelm這款新藥“放行”爬姓。但FDA同樣要求渤健公司進(jìn)行一項新的隨機(jī)對照臨床試驗,以驗證該藥物的臨床益處赖谷,如果試驗未能驗證臨床獲益慢沉,F(xiàn)DA可能會啟動程序以撤回對該藥物的批準(zhǔn)。無論如何滥氏,阿爾茨海默病的發(fā)病機(jī)制是非常復(fù)雜的备洽,如果針對淀粉樣蛋白的Aduhelm藥物治療可以取得成功,它將造福千千萬萬的阿爾茨海默病患者妈踊,為無數(shù)家庭帶去希望了嚎。[1]FDA,FDA Grants Accelerated Approval for Alzheimer’s Drug,2021-06-07,https://www.fda.gov/news-events/press-announcements/fda-grants-accelerated-approval-alzheimers-drug?utm_medium=email&utm_source=govdelivery
[2] 鄒前,侯凱,刁崚峰,等. 阿爾茨海默病發(fā)病機(jī)制假說和藥物治療研究進(jìn)展[J]. 吉林醫(yī)藥學(xué)院學(xué)報,2020,41(5):372-374.[3] 王婭寧. 抗阿爾茨海默癥藥物的研究進(jìn)展[J]. 東方藥膳,2020(9):295.[4] 邱雪梅. 阿爾茨海默病的非藥物治療研究進(jìn)展[J]. 特別健康,2020(23):51.[5]華爾街見聞,從can't到can 這款阿爾茨海默病新藥獲批前到底經(jīng)歷了什么,2021-6-8,https://www.cnbeta.com/articles/tech/1137913.htm
版權(quán)聲明:本文為春雨醫(yī)生原創(chuàng)稿件,版權(quán)歸屬春雨醫(yī)生所有廊营,未經(jīng)授權(quán)禁止轉(zhuǎn)載歪泳,授權(quán)與合作事宜請聯(lián)系reading@chunyu.me
 AD新藥研發(fā)艱難
AD新藥研發(fā)艱難